Caso # 1 Varón de 68 años con antecedentes de diabetes mellitus insulinodependiente, hipertrofia prostática benigna (HPB) e hipertensión (HTA) que acude al servicio de urgencias con fatiga, fiebres subjetivas de dos días y disuria. Apoya las mialgias y las molestias lumbares. Él niega cualquier cirugía, procedimiento o uso de antibióticos recientes. Tuvo un episodio de vómitos no sanguinolentos ni biliosos antes de su llegada. El paciente informa que sus niveles de azúcar en sangre en casa hoy eran 273 y 315. Actualmente se queja de presión en la vejiga y no ha orinado en 6 horas. Está taquicárdico y febril. ¿Qué debe considerar en el diagnóstico diferencial? ¿Qué pruebas debería pedir? ¿Qué estudios de imágenes podrían ser útiles? Caso # 2 Un hombre de 82 años con antecedentes de HBP, HTA, diabetes, enfermedad coronaria (EC) y vértigo acude al servicio de urgencias con debilidad. Su esposa informa que su urólogo le hizo un procedimiento hace unos días, pero no está segura del nombre. Hoy ha estado vomitando y parece deshidratado. El paciente ha estado acostado en la cama desde ayer, pero normalmente está bastante activo con un andador. Tienen un gran viaje planeado para mañana y se preguntan si deberían cancelarlo. Los signos vitales incluyen FC 90, TA 105/76, FR 13, temperatura 38,4 C, SatO2 98% en AR. |
¿Qué debe buscar en el examen? ¿Qué medicamentos debería indicar? ¿El paciente necesita debe ser internado?
¿Qué es la prostatitis?
La prostatitis se puede dividir en varias subcategorías:
| Categoría | Descripción |
| Prostatitis bacteriana aguda | • Síntomas prostáticos severos • ITU aguda • Infección sistémica |
| Prostatitis bacteriana crónica | • +/- síntomas de prostatitis • ITU recurrente por el mismo microorganismo sin duración específica, pero los pacientes típicamente tienen síntomas por 3 meses o más. |
| Prostatitis crónica / síndrome de dolor pélvico crónico | • Negativo para ITU, pero con síntomas de vaciado • Los síntomas incluyen disfunción sexual, dolor pélvico y dificultades en el vaciado por más de tres meses • Dividido en las subcategorías inflamatoria y no inflamatoria |
| Prostatitis inflamatoria asintomática | • Inflamación prostática sin síntomas genitourinarios |
A los efectos de este artículo, nos centraremos en la prostatitis bacteriana aguda.
Los síndromes de prostatitis son relativamente comunes, especialmente en la población no anciana. La prevalencia estimada de todos los síndromes de prostatitis es del 8,2%. Para los pacientes menores de 50 años, es la afección urológica más común y para los mayores, el tercer diagnóstico más común.
En hombres con al menos un episodio previo de prostatitis, su probabilidad acumulada de tener otro episodio de prostatitis fue del 50% en pacientes de 80 años de edad y aumentó con la edad. La incidencia exacta y la prevalencia de la prostatitis bacteriana aguda se desconocen en el entorno del servicio de emergencias, pero se estima que la prostatitis bacteriana aguda contribuye al 4-10% de los casos generales de prostatitis observados en la comunidad.
Una de las complicaciones temidas de la prostatitis bacteriana aguda es el absceso prostático, una acumulación localizada de líquido purulento dentro de la próstata. La mayor incidencia de abscesos prostáticos se presenta en hombres de entre 50 y 60 años.
La incidencia de absceso prostático en hombres con VIH asintomático y SIDA es del 3% y 14% respectivamente. Los hombres que se someten a un procedimiento urológico como la biopsia de próstata son otro grupo notable, con aproximadamente el 10% de estos pacientes desarrollando abscesos de próstata.
¿Cómo se genera la prostatitis?
Aunque la próstata tiene mecanismos naturales para ayudar a prevenir infecciones, incluidos los inmunológicos (secreciones antibacterianas) o mecánicos (eyaculación y evacuación para limpiar la uretra prostática), el drenaje insuficiente o el reflujo urinario desde la uretra o la vejiga hacia la próstata pueden causar cálculos, fibrosis o inflamación.
La siembra también puede ocurrir por la inoculación después de procedimientos que involucran la uretra y la próstata.
La prostatitis bacteriana aguda es probablemente causada por una infección urinaria ascendente a los conductos intraprostáticos.
Los organismos implicados en la prostatitis también pueden tener niveles más altos de ciertos factores de virulencia en comparación con la cistitis simple u otras infecciones genitourinarias.
¿Cuáles son los factores de riesgo para desarrollar prostatitis?
| Categoría | Ejemplo |
| Infecciones genitourinarias concurrentes | Cistitis Uretritis Epididimitis |
| Obstrucción mecánica Anormalidades neurofisiológicas | Estenosis uretral Fimosis |
| Instrumentación | Uso crónico de sonda Foley Cateterismo vesical intermitente Catéter tipo condón Biopsia de próstata Cistoscopía |
| Inmunosupresión | HIV |
| Otros | Coito anal receptivo |
En la literatura se han mencionado otros factores de riesgo: trauma, abstinencia y deshidratación, pero falta evidencia de alta calidad que respalde esto.
¿Qué organismos causan la prostatitis?
De manera similar a infecciones genitourinarias, las bacterias gramnegativas son la causa más común. E. Coli constituye la inmensa mayoría (hasta el 88% de los casos de prostatitis bacteriana aguda). Otras especies de Enterobacteriaceae como Klebsiella y Proteus constituyen aproximadamente el 10-30% de los casos conocidos. Con menos frecuencia, están implicadas Pseudomonas y otros Enterococcus.
También se debe tener en cuenta otros organismos, específicamente los cocos grampositivos como Staphylococcus aureus, ya que los expertos creen que la prevalencia está aumentando. La bacteriemia por infecciones por Staphylococcus aureus puede infectar agudamente la próstata. Esto también debería justificar la investigación de una infección oculta en otra ubicación, como la endocarditis, los tejidos blandos o un catéter vascular.
> Poblaciones especiales
Las personas con procedimientos de próstata recientes pueden tener más probabilidades de ser infectadas por bacterias resistentes a las fluoroquinolonas y Pseudomonas, probablemente debido al uso de antibióticos profilácticos. Chlamydia trachomatis y Neisseria gonorrhoeae también se pueden observar en pacientes sexualmente activos, sin importar la edad del paciente.
Además de los patógenos bacterianos comunes, los pacientes con VIH también pueden tener Salmonella typhi o Neisseria gonorrhoeae. Los viajeros a Asia y Australia pueden tener Burkholderia pseudomallei, que también se ha relacionado con el desarrollo de abscesos prostáticos. Los inmunodeprimidos, como los pacientes con diabetes o VIH, tienen más probabilidades de desarrollar abscesos prostáticos.
Presentación clínica de la prostatitis bacteriana aguda
Clásicamente, los pacientes con prostatitis bacteriana aguda presentarán fiebre y síntomas constitucionales además de molestias urinarias como incontinencia de urgencia o vacilación. También pueden informar orina turbia y dolor genitourinario.
Es posible que otros pacientes simplemente presenten síntomas similares a los de la gripe (náuseas, debilidad, escalofríos), por lo que realizar una buena historia clínica es fundamental para asegurarse de que no se pierda este diagnóstico.
> Examen físico
Al abordar el examen físico en pacientes masculinos con molestias genitourinarias, los médicos deben asegurarse de inspeccionar visualmente el periné y los genitales, palpar masas u otras anomalías y realizar un examen rectal digital.
La próstata suele estar sensible, edematosa y blanda en el tacto rectal, con una sensibilidad del 63,3% y una especificidad del 77,7%. Otras fuentes informan que más del 95% de los pacientes presentan sensibilidad prostática en el examen.
La fluctuación puede sugerir un absceso, con una amplia incidencia del 16-88%. En algunos casos, esto es todo lo que se necesita para establecer el diagnóstico. No se recomienda el masaje prostático, pero la palpación de una próstata suave en sí es generalmente segura.
La palpación del abdomen para investigar la distensión de la vejiga o el dolor a la palpación del flanco también puede ser útil al considerar otros diagnósticos. También puede haber espasmo del esfínter rectal.
> Estudios de laboratorio e imágenes
Aunque definitivamente no es necesario para confirmar el diagnóstico, los pacientes pueden tener leucocitosis y marcadores inflamatorios elevados como VSG o PCR. Actualmente no existen estudios cuantitativos que evalúen su papel en el diagnóstico de prostatitis bacteriana aguda. El PSA sérico generalmente no está disponible en el departamento de emergencias y es de utilidad limitada en la fase aguda de la enfermedad.
El análisis de orina puede ser importante para bacterias y piuria. Los resultados del cultivo del chorro medio miccional junto con la tinción de Gram también son útiles para determinar el microbio responsable. (Asociación Canadiense de Urología: Recomendación de nivel IIA).
Las pruebas de orina antes y después del masaje prostático se han utilizado para diagnosticar la prostatitis crónica, pero el masaje prostático está contraindicado en la prostatitis bacteriana aguda debido a la posibilidad de causar bacteriemia.
Un estudio determinó que la sensibilidad de los nitritos era del 55-58% y la esterasa leucocitaria del 81-83% en pacientes con prostatitis bacteriana aguda. Se debe considerar la realización de pruebas de gonorrea y clamidia en pacientes sexualmente activos. A menos que los pacientes tengan valvulopatías, sospecha de endocarditis o sepsis, los hemocultivos de rutina no son necesarios.
En pocas palabras: ¡La prostatitis es un diagnóstico clínico! El análisis y el cultivo de orina pueden ser negativos, así que asegúrese de considerar un cuadro clínico más amplio.
Los estudios de imágenes no suelen ser necesarios a menos que exista una alta sospecha de absceso prostático o el paciente sea de alto riesgo, siendo la ecografía y la TC las posibles modalidades de imagen (Asociación Urológica Canadiense: Recomendación de nivel IIIB / IIA).
Ecografía transrectal se recomienda de primera línea como una modalidad de imagen barata en comparación con otras alternativas, con una sensibilidad del 80-100% para los abscesos prostáticos.
Sin embargo, esta modalidad está contraindicada en pacientes con dolor intenso, fístulas y hemorroides severas. Este enfoque también tiene el beneficio de una intervención terapéutica como la aspiración con aguja, con una serie de casos que informa una tasa de éxito del 86%.
La tomografía computada con y sin contraste intravenoso puede ser útil para determinar la extensión de la enfermedad, es decir, en relación con la diseminación necrotizante y es la modalidad de imagen preferida para evaluar abscesos prostáticos enfisematosos.
No existen estudios recientes que evalúen la sensibilidad y especificidad de la TC en el diagnóstico de prostatitis o abscesos prostáticos. Aunque la resonancia magnética tiene una sensibilidad más alta que la tomografía computada, no se ha demostrado que sea mejor que la ecografía transrectal.
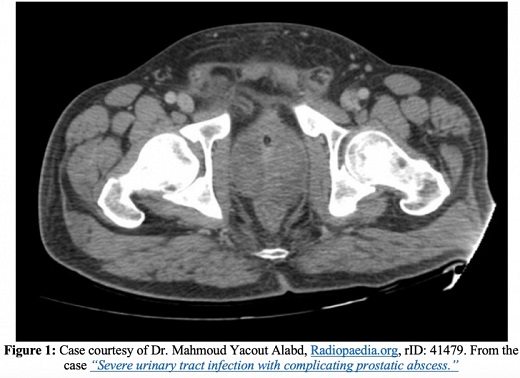
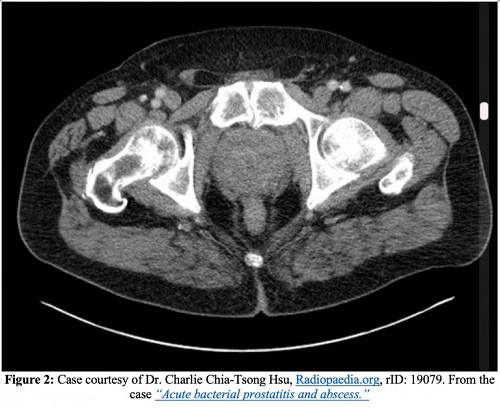
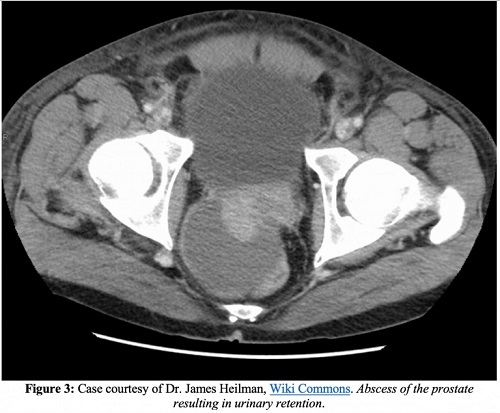
Complicaciones
Además de la endocarditis, la epididimitis, una mayor propagación de la infección a los espacios óseos o articulares y el desarrollo de una prostatitis crónica, una de las complicaciones más graves de la prostatitis aguda es un absceso prostático. En las imágenes de TC, los abscesos prostáticos aparecen como acumulaciones de líquido que no realzan. Los abscesos prostáticos aparecerán como áreas anecoicas o hipoecoicas en la ecografía transrectal.
Es posible que se requiera una evaluación urológica para un posible drenaje del absceso si el absceso prostático continúa después de al menos una semana de antibióticos, en ciertos pacientes refractarios o en aquellos que han fallado el tratamiento.
La retención urinaria aguda es una complicación conocida de la prostatitis aguda. Algunas fuentes recomiendan renunciar a la inserción del catéter de Foley a favor del cateterismo suprapúbico debido al riesgo potencial de ruptura del absceso o shock séptico. Otros recomiendan una caterización única con una prueba de micción o una sonda foley uretral de pequeño calibre a corto plazo. Se recomienda la consulta con urología.
Diagnóstico diferencial
Quizás el diagnóstico alternativo más importante es una ITU. Recuerde que la instrumentación a través de un procedimientos recientes o anomalías anatómicas como la estenosis o la HPB pueden predisponer a las personas a desarrollar infecciones urinarias y, por lo tanto, prostatitis.
Los pacientes que no responden al tratamiento de la cistitis aguda deben ser evaluados por una posible prostatitis. Si bien los pacientes con HPB pueden informar síntomas urinarios, no deben tener fiebre u otros hallazgos infecciosos en su evaluación de laboratorio. La sensibilidad de la próstata puede ayudar a diferenciar la prostatitis de otros diagnósticos como la epididimitis o la uretritis.
Manejo y tratamiento
El pilar del tratamiento de la prostatitis bacteriana aguda no complicada son los antibióticos.
¿Cuándo debe internarse a los pacientes?
Los pacientes sin hallazgos de inestabilidad hemodinámica, sospecha de sepsis inminente, comorbilidades importantes y tolerancia a la medicación oral pueden tratarse de forma segura como pacientes ambulatorios con seguimiento urológico ambulatorio.
Los pacientes que no sean fiables, sin un buen seguimiento o con alta sospecha de bacteriemia deben ser internados. Finalmente, los pacientes que desarrollen retención urinaria aguda deben ser monitoreados de cerca ya que pueden requerir un cateterismo vesical y una posterior hospitalización.
¿Cuál es el mejor antibiótico para usar?
Aunque no existen pruebas de ensayos comparativos, se deben tener en cuenta los patrones de resistencia local y los antibiogramas. La trimetoprima-sulfametoxazol no debe usarse como agente de primera línea si la resistencia regional a E. Coli es superior al 10-20%.
Las fluoroquinolonas tienen tasas de curación más altas, pero considere los efectos secundarios y las posibles reacciones adversas en sus pacientes. Elija el tratamiento basándose en el organismo más probable, lo que para la mayoría de las personas significa que la cobertura de gramnegativos es clave.
| Régimen antibiótico | |
| Pacientes ambulatorios | • Trimetoprima-sulfametoxazol (DC) VO cada 12 horas* • Ciprofloxacina 500 mg VO cada 12 horas • Levofloxacina 500 mg VO cada 24 horas |
| Sexualmente activos | • Ceftriaxona 250 mg IM x 1 dosis + doxiciclina 100 mg VO dos dosis diarias por 14 días |
| Pacientes hospitalizados | • Ciprofloxacina 400 mg IV dos veces al día o levofloxacina 750 mg IV por día +/- gentamicina o tobramicina 5 mg/kg IV al día • Betalactámico (ej. Piperacilina/tazobactam 4,5 g IV cada 6 horas o ceftazidima) +/- gentamicina IV o tobramicina 5mg/kg IV por día |
| Fluoroquinolona-resistentes | • Ertapenem 1 g IV por día • Ceftriaxona 1 g IV por día • Imipenem 500 mg cada 6 horas • Tigeciclina 100 mg IV x 1 dosis, luego 50 mg cada 12 horas |
| Bacteriemia o absceso prostático | • Ciprofloxacina 400 mg IV dos veces al día • Levofloxacina 500 mg IV cada 24 horas • Ceftriaxona 1-2 g IV por día + levofloxacina 500-750 mg • Ertapenem 1 g IV por día • Piperacilina-tazobactam 3,375 g IV cada 6 horas |
Considere agregar un aminoglucósido si el paciente tomó antibióticos recientemente o parece estar séptico. Se han revisado tetraciclinas y macrólidos en la literatura, con un éxito limitado en comparación con los agentes mencionados en el cuadro.
Existe cierta controversia con respecto a la duración ideal de la terapia, con fuentes que van desde dos a seis semanas. Clínicamente, los pacientes deben comenzar a sentirse mejor con la remisión de la fiebre y la disuria dentro de la primera semana de tratamiento con antibióticos.
Otras Consideraciones
Los pacientes que nunca han usado alfabloqueantes y que han sido diagnosticados recientemente con prostatitis bacteriana aguda pueden tener una mejoría sintomática al agregar estos a su régimen de tratamiento. Aunque la literatura urológica sostiene que los alfabloqueantes pueden mejorar los síntomas del paciente para todos los tipos de prostatitis, esto se basa en diferentes niveles de evidencia.
No existen ensayos específicos relacionados con la prostatitis bacteriana aguda y los datos son limitados. Otras decisiones sobre qué alfabloqueantes y a qué dosis se pueden tomar en conjunto con el servicio de urología. Los AINE también pueden ser de alguna utilidad.
Caso # 1
El examen físico del paciente se destaca por la sensibilidad de la próstata y la sensibilidad suprapúbica a la palpación. No tiene dolor a la palpación del ángulo costovertebral, lo que hace menos probable la pielonefritis. No tiene dolor testicular, lo que hace menos probable la epididimitis y la torsión. No presenta soplos, roces ni galope en el examen cardíaco, lo que hace menos probable la endocarditis o la enfermedad valvular.
Después de solicitar un análisis de orina con cultivo reflejo, hemograma completo, panel metabólico básico, se realiza una ecografía que muestra > 500 ml de orina. Después de hablar con Urología, se coloca un pequeño catéter de Foley uretral con resolución de la obstrucción. Urología recomienda ingresar al paciente y monitorizar la mejoría clínica durante 24 horas antes de solicitar una nueva ecografía. El paciente comienza con piperacilina/tazobactam y gentamicina y mejora poco después.
Caso # 2
En el examen, el paciente vomita activamente. Tiene membranas mucosas secas, pero sin molestias abdominales generalizadas. Tiene una gran sensibilidad a la palpación de la próstata sin sangre macroscópica u otra anomalía. Sus pulmones están limpios y no tiene hallazgos en la piel que sugieran infección. Debido a la preocupación por sepsis, se ordenan hemograma completo, panel metabólico básico, lactato, hemocultivos, análisis de orina con antibiograma y reposición de fluidos.
El paciente comienza empíricamente con ertapenem y se ordena una tomografía computada para evaluar un posible absceso prostático. Después de la reanimación, la condición del paciente mejora y, afortunadamente, el estudio de imagen no muestra acumulación de líquido. Se consulta a Urología sobre el paciente y se lo ingresa en el servicio de clínica médica.
Puntos clave
|