NefroPlus. Vol. 7. Núm. 1.enero 2015
INTRODUCCIÓN
Entre un 25 % y un 30 % de los pacientes diabéticos presentará algún grado de nefropatía a lo largo de su evolución. La nefropatía diabética se caracteriza desde el punto de vista clínico por la elevación de la excreción urinaria de albúmina en estadios iniciales, que puede progresar a lo largo de los años a proteinuria, llegando incluso a rango nefrótico y deterioro de la función renal progresivo.
En la diabetes mellitus (DM) tipo 1, la nefropatía incipiente aparece a los 15 años de media desde el diagnóstico, con una incidencia estable en los últimos años1. A partir del quinto año desde el diagnóstico debe empezar a determinarse el cociente albúmina/creatinina en orina.
En el caso de la DM tipo 2, mucho más prevalente y en aumento, el riesgo es mayor, de forma que a los 30 años de evolución casi la mitad de estos pacientes presentará nefropatía2. El tiempo medio desde el inicio de la proteinuria hasta la insuficiencia renal crónica terminal o el inicio de diálisis suele ser de siete años. Hoy en día es la causa más importante de entrada en diálisis, de acuerdo con los datos del Registro Español de Enfermos Renales (www.registrorenal.es).
La aparición de un síndrome nefrótico en un paciente diabético pudiera parecer a priori un diagnóstico evidente de nefropatía diabética.
Dado que se caracteriza por un desarrollo progresivo acorde con la evolución y el control de la diabetes, la presencia de un síndrome nefrótico de otras características (evolución rápida, presencia de hematuria) obliga a descartar otras causas y a valorar la necesidad de realizar una biopsia renal.
CASO CLÍNICO
Paciente de 80 años de edad, hipertensa de larga evolución, bien controlada y diabética tipo 2 desde hace 25 años, en tratamiento con antidiabéticos orales por reacción alérgica a varios tipos de insulina, con mal control metabólico y retinopatía diabética no proliferativa.
Entre otros antecedentes personales, presenta hiperuricemia asintomática sin tratamiento, anemia ferropénica en tratamiento con hierro oral, bocio multinodular normofuncionante y arritmia completa por fibrilación auricular de varios años y en tratamiento con anticoagulación oral, con varios episodios de insuficiencia cardíaca.
Sigue tratamiento con apixabán, metformina/vildagliptina, glicazida, furosemida, diltiazem, losartán, omeprazol, simvastatina y ferroglicina sulfato.
La paciente es ingresada en el servicio de Medicina Interna (MI) en julio de 2014 por un cuadro clínico compatible con gastroenteritis vírica y oliguria. En la exploración se encuentra normotensa y presenta edemas perimaleolares con fóvea, bilaterales. En la analítica (tabla 1) se observa un deterioro de la función renal (creatinina plasmática [Crp]: 3,4 mg/dl) que se cataloga como prerrenal, mejorando parcialmente con fluidoterapia hasta Crp 1,7 mg/dl.
Se ha de destacar que previo al ingreso la paciente presentaba función renal normal (Crp: 0,7 mg/dl; filtrado glomerular estimado [Modification of Diet in Renal Disease, MDRD-4] > 60 ml/min/1,73 m2) sin alteraciones urinarias (elemental y sedimento [EyS]: normal; cociente albuminuria/Cr: 2,5 mg/g).
En el resto de las pruebas complementarias (PC) del ingreso destacaba hipertrigliceridemia (227 mg/dl), hipoproteinemia (5,2 g/dl) e hipoalbuminemia (2,8 g/dl), anemia ferropénica (hemoglobina [Hb]: 10,7 g/dl; VCM: 76 fL; ferritina: 39 ng/ml) y proteinograma sin banda monoclonal. En el EyS presentaba: proteínas ++++, indicios de hemoglobina, 1-3 hematíes/campo y 4-8 leucocitos/campo, con un sodio en orina de 34 mmol/l. La ecografía renal Doppler no mostró alteraciones. Tras mejoría clínica y analítica, la paciente es dada de alta.
Quince días después acude de nuevo a urgencias por síndrome general, disnea, edemas y oliguria en la última semana, con diarrea y rectorragias. Al reinterrogarla, admite consumo de ibuprofeno habitual (600 mg cada 8-12 horas los últimos tres meses) y es ingresada en Nefrología. En la exploración física presenta tensión arterial de 168/76 mmHg, ingurgitación yugular, auscultación pulmonar con roncus, sibilantes y crepitantes basales, y edemas con fóvea hasta rodillas.
En las PC se observa Crp: 4,9 mg/dl, proteínas: 4,7 g/dl, albúmina: 2,3 g/dl, colesterol: 242 mg/dl, triglicéridos: 208 mg/dl, Hb: 11,7 g/dl, leucocitos: 8700/¿O, linfocitos: 14,2 %, segmentados: 69,2 %, eosinófilos: 5,1 %, EyS: proteínas ++, Hb ++, 15-20 hematíes/campo, 80-100 leucocitos/campos, bacteriuria moderada, sodio en orina: 28 mEq/l, proteinuria en 24 horas > 10 g, proteinuria de Bence Jones negativa, inmunoglobulinas y complemento normales, ANA, ANCA, anti-MBG, factor reumatoide, anti-PLA2R y serologías virales negativas.
Durante el ingreso se observa un progresivo empeoramiento de la función renal hasta Crp 6 mg/dl, permaneciendo en anuria y anasarca que no responde a diurético intravenoso en dosis altas, por lo que precisa iniciar hemodiálisis.
En resumen, síndrome nefrótico de aparición brusca e insuficiencia renal rápidamente progresiva en paciente diabética. Se realizó biopsia renal.
EVOLUCIÓN
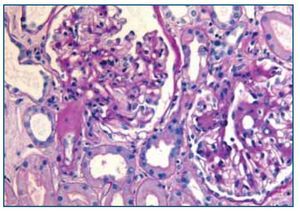
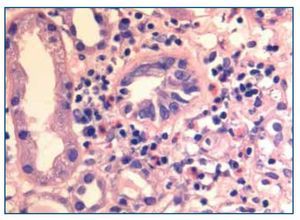
La biopsia renal mostró glomeruloesclerosis segmentaria y difusa con formación de nódulos eosinófilos PAS positivos (figura 1). Las arteriolas presentaban hialinosis franca PAS positiva y el intersticio mostraba fibrosis marcada con infiltrados difusos inflamatorios formados por linfocitos maduros y numerosos eosinófilos que producían imágenes de tubulitis (figura 2). La inmunofluorescencia resultó débilmente positiva para IgM mesangial, sin otros hallazgos. El rojo Congo fue negativo.
Figura 1. Biopsia renal. Imagen de microscopía óptica con tinción de hematoxilina-eosina. La imagen muestra lesiones de Kimmelstiel Wilson (glomeruloesclerosis nodular) e hialinosis arteriolar. Imagen cedida por Dr. Javier Gómez (Servicio de Anatomía Patológica. Hospital Universitario Marqués de Valdecilla, Santander).
Figura 2. Biopsia renal. Imagen de microscopía óptica con tinción de hematoxilina-eosina. La imagen muestra tubulitis e infiltrado intersticial por eosinófilos. Imagen cedida por Dr. Javier Gómez (Servicio de Anatomía Patológica. Hospital Universitario Marqués de Valdecilla, Santander).
Por tanto, el diagnóstico histológico fue de nefropatía diabética (glomeruloesclerosis nodular y difusa con hialinosis arteriolar) y nefropatía túbulo-intersticial con eosinofilia sugestiva de toxicidad farmacológica.
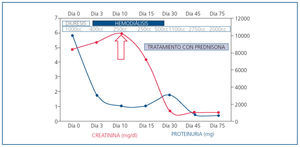
Con el diagnóstico de nefritis intersticial inmunoalérgica por antiinflamatorios no esteroideos (AINE) sobreimpuesto a nefropatía diabética, se inició tratamiento con prednisona por vía oral en dosis de mg/kg de peso. Tras diez días de tratamiento, se produce aumento progresivo de la diuresis y recuperación de la función renal normal (Crp: 0,6 mg/dl; FGe por MDRD-4: > 60 ml/min/1,73 m2) que permitió cese del tratamiento renal sustitutivo (figura 3).
Figura 3. Evolución clínica y analítica.
Durante el ingreso presentó una progresiva anemización hasta una Hb de 8 g/dl, sin plaquetopenia y con lactato deshidrogenasa normal, por lo que se descartó que fuera de origen hemolítico, siguiendo el mismo curso que el deterioro de la función renal, lo que sugería que estaba en relación con el propio fracaso renal agudo. La rectorragia se autolimitó en dos días, con desaparición de la diarrea. En el ingreso previo en MI se había realizado una tomografía axial computarizada abdominal sin contraste sin evidenciarse patología, con determinación de sangre oculta en heces negativa y estudio de coagulación normal, por lo que no se amplió el estudio. Se advirtió mejoría de la anemia (Hb: 11,6 g/dl) tras transfusión sanguínea, tratamiento con hierro endovenoso y eritropoyetina.
Se ajustó el tratamiento antihipertensivo, reiniciando antagonista de los receptores de la angiotensina II (ARA II), calcioantagonista y alfabloqueante, con buen control. Además, se modificó la insulinoterapia con mejor control glucémico y se reintrodujo anticoagulación oral sin complicaciones y tratamiento hipolipemiante.
Tras dos meses de prednisona oral en pauta descendente, se produce una mejoría progresiva de proteinuria, siendo el cociente proteínas/creatinina en orina de 756 mg/g en la última revisión.
DISCUSIÓN
Como se menciona en varios comentarios, la nefropatía diabética de base es un diagnóstico posible, teniendo en cuenta que la paciente presentaba una diabetes de larga evolución mal controlada. Asimismo, la presencia de retinopatía diabética se asocia fuertemente con nefropatía diabética3, aunque puede existir afectación renal sin retinopatía4.
Como también se apunta, nuestra paciente presenta un síndrome nefrótico con una proteinuria masiva, con repercusión en proteínas séricas junto con deterioro de la función renal y clínicamente en anasarca. La comparación con analíticas previas recientes es clave en nuestro caso, ya que comprobamos que el debut de síndrome nefrótico es brusco, y un deterioro tan abrupto obliga a la realización de biopsia renal para descartar otras glomerulopatías diferentes de la propia nefropatía diabética.
En una revisión reciente recomiendan la realización de biopsia renal en pacientes diabéticos con deterioro de la función renal y las siguientes características: ausencia de retinopatía diabética, transcurso de < 5 años desde el diagnóstico de la DM, ausencia de cronología típica como debut agudo de proteinuria, deterioro progresivo de la función renal, presencia de hematuria, presencia de otra enfermedad sistémica y síndrome nefrótico franco5, como es el caso de nuestra paciente.
Entre los comentarios de los lectores, destaca la nefritis inmunoalérgica por AINE, que puede cursar con síndrome nefrótico en el contexto de nefropatía por cambios mínimos6 o nefropatía membranosa7. Cursa típicamente con hematuria, proteinuria, leucocituria y elevación de la Crp. También puede aparecer eosinofilia (presente en este caso) y rash.
Como bien se ha mencionado, la hematuria tampoco es característica de la nefropatía diabética por sí sola. Si bien en algún estudio se ha encontrado asociación entre hematuria persistente e hialinosis arteriolar como la existente en la biopsia de nuestra paciente, no se ha demostrado que esto sea relevante en el curso clínico y en el pronóstico de la nefropatía diabética8. También se ha descrito la relación entre anticoagulación con warfarina y la hematuria macroscópica con fracaso renal agudo secundario a obstrucción tubular por cilindros hemáticos9. Estos hallazgos no se encontraron clínica ni histológicamente en nuestra paciente. Además, esta recibía como anticoagulación uno de los nuevos anticoagulantes orales (apixaban) y, dado que su uso es reciente aún, no hay ningún caso descrito similar a los relacionados con los anticoagulantes clásicos.
Se apunta en varios comentarios la posibilidad de una nefropatía membranosa secundaria a un proceso neoplásico. La ausencia de anticuerpos anti-PLA2R favorece el diagnóstico de causa secundaria frente a idiopática10. Es una buena opción, dado que es la razón más frecuente de síndrome nefrótico en pacientes añosos no diabéticos, pero la histología y los marcadores tumorales normales no apoyaron este diagnóstico.
Es cierto que en pacientes de edad avanzada con síndrome nefrótico se debe considerar el diagnóstico de discrasia sanguínea como el mieloma múltiple o la amiloidosis. En nuestro caso el proteinograma fue normal y la proteinuria de Bence Jones negativa, así como la tinción en la biopsia renal de rojo Congo, lo que descartó estas posibilidades.
También es cierto que el estado de anasarca junto con la diarrea justificarían cierto componente de insuficiencia renal prerrenal. La hipoalbuminemia era importante, pero no llegó al rango severo (< 2 g/dl), y se descartó trombosis de la vena renal mediante ecografía Doppler.
Respecto a la relación del fracaso renal agudo con una posible etiología infecciosa, se aisló Klebsiella pneumoniae en orina en ausencia de fiebre ni clínica, por lo que no recibió tratamiento antibiótico. No existía hipocomplementemia que orientara hacia una glomerulonefritis posinfecciosa; tampoco hallazgos a favor de un síndrome hemolítico urémico típico, si bien la paciente presentó diarrea, que se autolimitó, y no había datos de hemólisis, por lo que no requirió la realización de otras pruebas.
Asimismo, el complemento normal no sugiere enfermedad ateroembólica a pesar de la eosinofilia, sin existir tampoco historia de cateterismo reciente.
Los ANCA y los niveles de inmunoglobulinas fueron normales y no había presencia de semilunas en la biopsia, por lo que la vasculitis o un brote extracapilar de nefropatía IgA no se consideraron en el diagnóstico diferencial.
Acerca del tratamiento de esta entidad, no hay evidencia clara del beneficio de la terapia con corticoides, pero puede considerarse en caso de insuficiencia renal de más de una o dos semanas de duración11. En todos los casos deben suspenderse los AINE, consiguiéndose habitualmente una recuperación espontánea en el plazo de semanas o meses. En el estudio observacional retrospectivo del Grupo Madrileño de Nefritis Intersticiales, se analizaron 61 pacientes biopsiados con diagnóstico de nefritis túbulointersticial aguda por fármacos, que en la mayoría de los casos fue debida a AINE y antibióticos (93 %). Observaron que los pacientes no sometidos a esteroides tuvieron una Crp más alta al final del seguimiento (3,7 ± 2,9 frente a 2,1 ± 2,1 mg/dl) y mayor necesidad de diálisis (44,4 % frente a 3,8 %). Además, encontraron una clara relación entre el tiempo transcurrido entre la suspensión del fármaco causante y el inicio de esteroides, dado que estos pueden actuar precozmente sobre el infiltrado inflamatorio y evitar la progresión a fibrosis. Los pacientes que recuperaron completamente la función renal habían iniciado antes el tratamiento con esteroides respecto a los que lo hicieron más tardíamente (18,4 ± 16 días frente a 31,4 ± 15 días)12.
CONCLUSIONES
El síndrome nefrótico en pacientes diabéticos es debido en la mayor parte de los casos, aunque no en todos, a la nefropatía diabética. La diabetes con mal control metabólico, de largo tiempo de evolución (al menos cinco años en la DM tipo 1 y más incierto en la DM tipo 2 por su inicio más insidioso y retraso diagnóstico), y la presencia de retinopatía diabética son sugestivas de nefropatía diabética.
Al contrario, en pacientes de corta evolución de la diabetes con síndrome nefrótico de rápido desarrollo o aparición de hematuria son datos que deberían hacernos sospechar otra causa de afectación y plantearnos la necesidad de realizar una biopsia renal.
En nuestro caso, el antecedente de consumo de AINE hacía posible un diagnóstico compatible con nefritis túbulo-intersticial aguda, que produce un rápido deterioro de la función renal y un síndrome nefrótico franco impuro.
El tratamiento sigue siendo controvertido, aunque es primordial retirar el fármaco nefrotóxico y en caso de fracaso renal agudo establecido se debe valorar el tratamiento con corticoides, que pueden producir una respuesta en poco tiempo.
Respecto a la nefropatía diabética, es importante conseguir buen control glucémico y de la tensión arterial, de la proteinuria con inhibidores de la enzima convertidora de la angiotensina o ARA II, y del resto de los factores de riesgo cardiovascular asociados.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.